
Белок-шип как неопровержимое доказательство усиления функциональности SARS-CoV-2
Предисловие здесь
Коронавирусы названы так из-за короны (по-латыни corona), которую представляет из себя внешняя поверхность вируса. Изображение SARS-CoV-2, полученное с помощью просвечивающего электронного микроскопа, показывает вирус с короной из белков-шипов, исходящих из его мембраны [1]. Следующая электронная микрофотография коронавирусов, прикрепляющихся к клеткам легких человека и внутри них, показывает типичный внешний вид короны из белков-шипов, который дает название семейству вирусов: coronaviridae или коронавирус [2].
Снова обратимся к первому изображению на вставке с цветными фотографиями. На этом рисунке показан белок-шип в увеличенном виде, показывающем его молекулярную структуру и критические компоненты, появившиеся после изменений вследствие усиления функциональности, обсуждавшихся в предыдущих главах.
В 2015 году доктор Фанг Ли написал мини-обзор, финансируемый грантом NIH RO1AI089728, в котором обсуждается важность распознавания не только С-концевого домена части S1 белка-шипа, но и N-концевого домена (NTD) [3]. В этот обзор было включено обсуждение важности DPP4 и его роли в воспалении и высвобождении цитокинов, а также важность вируса трансмиссивного гастроэнтерита (TGEV), который Барик подверг мутациям, сделав вирус заразным в 2000 году, как показано ранее в этой книге. NTD вируса TGEV особенно проблематична, потому что эта область белка-шипа распознает N-гликолилнейраминовую кислоту (Neu5Gc), о которой мы ранее говорили как о проблеме, объясняя «воспаление», связанное с некоторыми продуктами животного происхождения [4]. Другие разделяют эту озабоченность [5].
Прежде чем обращаться к конкретным вставкам и возникающим в их результате конформационным изменениям белка-шипа, важно понять, что образование антител не всегда является благом. Этот процесс, как я первоначально объяснил в «Теории воспаления и сердечных заболеваний», также может быть опасным, особенно в случае заражения вирусом «правильного» типа. Иногда эти антитела, как в случае Streptococcus pneumoniae (ангина), могут вызывать повреждение клапанов вашего сердца, вызывая ревматический порок сердца. В других случаях, например, при образовании антител к N-концу SARS-CoV-2, это может повысить заразность вируса в 4-10 раз [6], усилить заболевание [7] и снизить выживаемость пациентов [8].
Обсудив ранее важность TMPRSS2 и тех, кто участвовал в открытии этого, важно знать, что этот фермент, который генетически закодирован, играет важную роль в восприимчивости людей к воздействию SARS-CoV-2. Как только рецептор-связывающий домен белка-шипа присоединяется к рецептору ACE2, в игру вступает клеточный рецептор протеазы TMPRSS2. И ACE2, и TMPRSS2 являются основными факторами проникновения вируса в клетку [9].
Поскольку все белки и структуры в нашем теле закодированы на основе нашего специфического генетического кода, специфичность SARS-CoV-2 и ряда рецепторов, которые он использует для последовательного проникновения в наши клетки, имеют решающее значение для понимания различий в восприимчивости. Мы уже обсуждали гены/хромосомы, связанные с ACE2 и TMPRSS2. Однако дальнейший анализ ACE2 и TMPRSS2 показывает значительные различия между расами:
Мы обнаружили, что полиморфизмы ACE2 с большей вероятностью были связаны с сердечно-сосудистыми и легочными заболеваниями за счет изменения взаимодействий ангиотензиноген ― ACE2, таких как p.Arg514-Gly, у африканской/афроамериканской популяции. Уникальные, но распространенные полиморфизмы в TMPRSS2, включая p.Val160Met (rs12329760), могут дать потенциальное объяснение различной генетической предрасположенности к COVID-19, а также факторов риска, включая рак и группу пациентов мужского пола с высоким риском [10]. [Выделение добавлено].
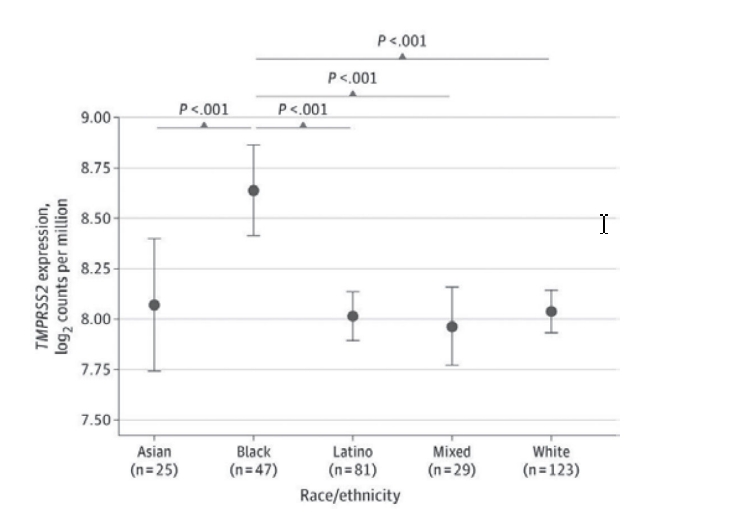
Фактически, экспрессия TMPRSS2 значительно выше у чернокожих людей, чем у представителей любой другой расы, как показано на следующем рисунке [11].
Хотя мы знаем, что Питер Дашак приложил значительные усилия, чтобы опровергнуть создание SARS-CoV-2 путем усиления функциональности, ― учитывая, что он, несомненно, потерял бы финансирование от правительства США, если бы возникла обеспокоенность этим, ― его общение [12] с отдельными лицами, в том числе доктором Линфа Ваном с медицинского факультета Национального университета Сингапура (NUS) и доктором Ральфом Бариком из Университета Северной Каролины демонстрируют попытки Дашака дистанцироваться от Ванга и Барика, которые сотрудничали с доктором Ши Чжэнли из Уханьского института вирусологии в течение многих лет. Цитируемое далее было получено по запросу, поданному в соответствии с законом о свободе информации организацией US Right to Know [13].
Как показано в последних двух главах, федеральное правительство Соединенных Штатов оплатило исследования по усилению функциональности и генетическим манипуляциям и включено в патенты, полученные в результате этой работы. Его роль в разработке SARS-CoV-2 демонстрирует его виновность ― как уголовную, так и гражданскую ― за вред, причиненный не только в Соединенных Штатах, но и во всем мире, независимо от того, что вирус распространился из лаборатории Уханьского института вирусологии.

Пришло время взглянуть на два изменения, внесенные в белок-шип SARSCoV-2, и изменение в результате этого в региональном сайте связывания (RBS), образующем прионоподобный домен в результате вставок PRRA и ВИЧ. Мы рассмотрим как доказательства внесения изменения путем усиления функциональности, так и вред, причиняемый в результате этого людям.
Вставка пролин-аргинин-аргинин-аланин (PRRA)
После присоединения белка-шипа вируса SARS-CoV-2 к рецептору ACE2, а затем к сайту TMPRSS2, белок-шип создает сайт расщепления белка особого типа. Этот шаг необходим для заражения людей SARS-CoV-2 [14], и связан с распространением вируса от клетки к клетке и заразностью вируса.
Было показано, что этот сайт расщепления фурином (PRRA) имеет решающее значение для других вирусов, включая вирус птичьего гриппа и вирус болезни Ньюкасла, и не был обнаружен ни в одном другом гриппе или коронавирусе [15].
Как показано на цветных рисунках, вставки PRRA нет ни в одном другом коронавирусе на планете [16]. Сайт расщепления фурином находится в стабильной части белка-шипа ― компоненте S1. Большинство, если не все мутации, наблюдаемые в SARS-CoV-2, происходят в компоненте S2 белка-шипа.
Последний интересный момент заключается в правах собственности и патентах на встраивание сайтов расщепления фуриновой протеазой в мембраны [17]. В патенте конкретно говорится: «Этот протокол может быть использован для получения доменов вирусных мембранных белков для структурного анализа и для испытаний в качестве вакцин».
Мы также знаем, что сайт расщепления фурином PRRA участвует в преобразовании сайта расщепления гликопротеина-предшественника оболочки ВИЧ gp160 [18] в gp120, который есть в сборке вируса ВИЧ [19]. Это приводит нас к нашему следующему усилению функциональности: gp120 вируса ВИЧ.

Гликопротеин 120 ВИЧ (HIV gp120)
Вторая вставка в результате усиления функциональности [20], которую мы можем доказать, включает HIV gp120. Как показано на первом рисунке цветной вставки, вставка gp120 в белке-шипе больше, чем вставка PRRA.
Мы знаем, что Ши Чжэнли-Ли призналась, что работала с белком-шипом коронавирусов после первоначальной вспышки в 2002 году с конкретным намерением повысить способность SARS-CoV заражать людей [21].
Теперь мы знаем, что gp120 ВИЧ прикрепляется к рафту рецептора сиаловой кислоты и связан с воспалением и свертыванием крови, впервые описанным мной в 1994 году, как обсуждалось ранее в этой книге, и что gp120 участвует не только в этой воспалительно-тромбозной реакции (COVID-19), но также и в прионных заболеваниях [22].
Мы также знаем, что в 2002 году, когда Чжэнли манипулировала белком-шипом и работала с псевдовирусом gp120 ВИЧ в рамках исследования по усилению функциональности коронавируса SARSCoV-1, уже было известно, что сам gp120 ВИЧ считается причиной прионных заболеваний головного мозга [23].
В 2010 году Чжэнли и ее коллеги начали исследование рецепторов ACE2 [24]. Ранее было показано, что:
белок ангиотензинпревращающего фермента 2 (ACE2), известного рецептора SARS-CoV, из подковоносой летучей мыши не мог действовать как функциональный рецептор для SARS-CoV [25].
Проводя тесты с использованием псевдовируса на основе ВИЧ и живого SARS-CoV-1, Чжэнли и другие смогли доказать, что если «несколько ключевых остатков» белка-шипа будут «изменены», то это может повысить заразность.
В 2013 году Чжэнли-Ли [26] начала работать с Ральфом Бариком [27] над белком-шипом HKU4 коронавируса MERS, именно это исследование привело к закрытию исследований по усилению функциональности в 2014 году [28]:
Перепроектировали шип HKU4 с целью увеличения его способности опосредовать проникновение вируса в клетки человека. С этой целью мы ввели две одиночные мутации. … Мутации этих мотивов в шипах коронавируса продемонстрировали драматический эффект на проникновение вируса в клетки человека. (При финансовой поддержке NIH, гранты RO1AI089728 и RO1AI110700.)
Презентация с результатами исследования, сделанная Чжэнли в Шанхайском университете Цзяо Тонг 14 ноября 2018 года под названием «Исследования коронавируса летучих мышей и его межвидовая передача», была удалена с веб-сайта университета.
После выхода из печати работы Чжэнли в 2002 году и до ее работы с белком-шипом HKU4, Чжэнли и другие сотрудники Уханьского института вирусологии использовали псевдовирус на основе ВИЧ, чтобы доказать, что SARS-подобный коронавирус (SL-CoV) не может инфицировать клетки человека или клетки подковоносых летучих мышей:
В этом исследовании для решения этих проблем использовалась псевдовирусная система на основе вируса иммунодефицита человека (ВИЧ). Наши результаты показали, что S-белок SL-CoV не может использовать белки ACE2 разных видов для проникновения в клетки и что S-белок SARS-CoV также не может связывать молекулу ACE2 подковоносой летучей мыши Rhinolophus pearsonii [29].
Далее они заявили о неспособности этих вирусов инфицировать клетки с помощью рецептора ACE2 независимо от его происхождения.
Наши результаты показали, что S-белок (Rp3) от SL-CoV летучей мыши не может использовать ACE2 для проникновения в клетку независимо от происхождения молекулы ACE2. Мы также продемонстрировали, что у заражающего людей SARS-CoV S-белок не может использовать RpACE2 летучей мыши в качестве функционального рецептора.
Генетические манипуляции (усиление функциональности) позволили гибридному белку S (шипу) инфицировать клетки:
Однако, когда участок RBD S-белка SL-CoV был заменен на RBD из S-белка SARS-CoV, гибридный белок S смог использовать huACE2 для проникновения в клетки.
В 2009 году китайские исследователи показали, что белок-шип SARS-CoV-1 включает полученные в результате слияния гликопротеины [30], обнаруженные в вирусных гликопротеинах класса I [31], такие как обнаруженные в ВИЧ [32]. По словам доктора Ли Мэн Ян, SARS-CoV-1 также был биологическим оружием, разработанным Коммунистической партией Китая (КПК) [33].
Как обсуждалось ранее, мы знаем, что сайт расщепления фурином (PRRA) отвечает не только за повышение заразности SARS-CoV-2, но также за преобразование gp160 ВИЧ в gp120 и gp41, демонстрируя его роль в ВИЧ-инфекциях и любых потенциальных вставках ВИЧ-материала (как обсуждалось ранее). Это вызывает дополнительные опасения по поводу комбинации вставок PRRA и ВИЧ gp120.
Мы также знаем из работ Прадхана и других, которые в настоящее время пересматриваются, что его исследовательская группа обнаружила то, что они считали четырьмя уникальными вставками в белок-шип SARS-CoV-2 [34].
Д-р Чжан и др. проанализировали эти четыре вставки, сравнивая эти генетические последовательности с известными последовательностями других вирусов, используя инструмент Basic Local Alignment Search Tool (BLAST) [35]. На цветной фотографии рецептор показан желтым цветом, причем вставки с 1 по 4 идентифицированы, как показано.
Исследователи пришли к выводу, что три из четырех вставок присутствуют в других коронавирусах:
Среди 4 «вставок» (IS) 2019-nCoV, IS1 имеет только 1 остаток, отличный от коронавируса летучих мышей, а 3 из 7 остатков идентичны MERS-CoV. IS2 и IS3 идентичны коронавирусу летучих мышей. Что же до IS4, то, хотя проверка локальной последовательности с помощью BLAST не дала совпадения с коронавирусами летучих мышей в таблице 4, она имеет тесную эволюционную связь с коронавирусом летучих мышей в MSA. В частности, первые 6 остатков во фрагменте IS4 «QTQTNSPRRA» из 2019-nCoV идентичны CoV летучей мыши, в то время как последние 4 остатка, которые отсутствуют в коронавирусе летучих мышей или SARS-CoV, имеют как минимум 50% идентичность с MERS-CoV и HCoV-HKU1 [36]. [Выделение добавлено.]
Взятые вместе, эти утверждения из исследований, оплаченных NIAID (AI134678) и Национальным научным фондом (DBI1564756, IIS1901191) ― оба агентства участвовали в финансировании исследований Дашака, Барика и Чжэнли по усилению функциональности, ― по всей видимости, подтверждают утверждения доктора Ли-Мэн Янь [37] о том, что SARS-CoV-1 был первым биологическим оружием и что SARSCoV-2 является усовершенствованной версией, если учесть сегмент PRRA.
Наконец, обратим внимание на профессора Люка Монтанье ― первооткрывателя вируса иммунодефицита человека (ВИЧ) [38]. Монтанье опубликовал одну статью [39] и подал на публикацию другую [40]. В обеих этих статьях Монтанье использует ту же самую технологию BLAST для анализа генетического кода SARSCoV-2.
Он отмечает восемнадцать фрагментов РНК, похожих на вирус иммунодефицита человека или обезьян (высшие приматы), которые могут изменить генетическую экспрессию COVID-19:
В геноме COVID_19 было обнаружено 18 фрагментов РНК, гомология которых равна или превышает 80% с ретровирусами человека или обезьяны. Эти фрагменты имеют длину от 18 до 30 нуклеотидов и, следовательно, могут изменять экспрессию гена Covid19. Мы назвали их внешними информационными элементами или EIE. Эти EIE не рассредоточены случайным образом, а сконцентрированы в небольшой части генома [41].
Это схематично показано на цветном рисунке, на котором обозначены экзогенные информационные элементы [42].
Как красноречиво заявил Монтанье, белок-шип не только имеет вставку PRRA (двенадцать нуклеотидных оснований), но также вставку из 1770 нуклеотидов [43] (590 аминокислот), совпадающую с ВИЧ-1:
Мы изучили самую последнюю генетическую эволюцию штаммов COVID_19, вовлеченных в мировую эпидемию. Мы обнаружили значительное количество мутаций и делеций в области 225 оснований.
На образцах геномов мы показываем, что эти 225 базовых ключевых областей каждого генома, богатые EIE, и 1770 базовых областей шипа развиваются намного быстрее, чем соответствующий полный геном (геномы от 44 пациентов из штата Вашингтон, Сиэтл, первоначальный эпицентр в США).
При сравнительном анализе генов белка-шипа COVID_19 и Bat RaTG13 мы отмечаем два аномальных факта:
1) вставка 4 смежных аминокислот PRRA в середину шипа (мы показываем, что этот сайт уже был оптимальным сайтом расщепления ДО этой вставки).
2) аномальное распределение синонимичных кодонов во второй половине шипа.
Наконец, мы показываем вставку в эти 1770 оснований шипа значимой пары EIEs от Plasmodium Yoelii и возможного EIE ВИЧ1 с критической мутацией шипа [44].
Как отметила Ян, этот тип редактирования генов при помощи усиления функциональности позволил создать новые коронавирусы, обладающие уникальными свойствами [45]!
 Перевод осуществлен членом РВС Иваном Ивановым
Перевод осуществлен членом РВС Иваном Ивановым
Ссылки к главе 4.
1. National Center for Biotechnology Information, “Severe Acute Respiratory Syndrome Cononavirus 2 Isolate Wuhan-Hu-1, Complete Genome,” July 18, 2020, https://www.ncbi.nlm.nih.gov/nuccore/1798174254.
2. “SARS-CoV Images,” Centers for Disease Control, last reviewed October 30, 2020, https://www.cdc.gov/sars/lab/images.html.
3. Fang Li, “Receptor Recognition Mechanisms of Coronaviruses: A Decade of Structural Studies,” Journal of Virology 89, no. 4 (February 2015): 1954–64.
4. R. M. Fleming et al., “Weight Loss v. Heart Disease: Weight Loss Is Determined by Caloric Intake. Heart Disease Is Determined by Dietary Inflammatory Components. True Quantification of Coronary Artery Disease Measured by AI Using FMTDM,” Archives of Medicine 10, no. 5 (2018): 3, doi:10.21767/1989-5216.1000284.
5. Michael Greger, “The Inflammatory Meat Molecule,” December 13, 2012, NutritionFacts.org. Video: 3:28, https://nutritionfacts.org/video/the-inflammatory-meat-molecule-neu5gc/.
6. M. Jaume, “Anti-Severe Acute Respiratory Syndrome Coronavirus Spike Antibodies Trigger Infection of Human Immune Cells via a pH-and Cysteine Protease-Independent FcγR Pathway,” Journal of Virology 85, no. 20 (2011): 10582–97.
7. Dapeng Li et al., “The Functions of SARS-CoV-2 Neutralizing and Infection-Enhancing Antibodies In Vitro and in Mice and Nonhuman Primates,” BioRXiv (February 18, 2021): https://doi.org/10.1101/2020.12.31.424729.
8. Yafei Liu, “An Infectivity-Enhancing Site on the SARS-CoV-2 Spike Protein Is Targeted by COVID-19 Patient Antibodies,” BioRXiv (December 18, 2020): https://doi.org/10.1101/2020.12.18.423358.
9. J. Shang et al., “Cell Entry Mechanisms of SARS-CoV-2,” Proceedings of the National Academy of Sciences 117, no. 21 (2020): 11727–34; Indwiani Astuti and Y. Ysrafil, “Severe Acute Respiratory Syndrome Coronavirus 2 (SARSCoV-2): An Overview of Viral Structure and Host Response,” Diabetes and Metabolic Syndrome 14, no. 4 (July-August 2020): 407–12.
10. Y. Hou et al., “New Insights into Genetic Susceptibility of COVID-19: An ACE2 and TMPRSS2 Polymorphism Analysis,” BMC Medicine 18 (2020): 216.
11. S. Bunyavanich et al., “Racial/Ethnic Variation in Nasal Gene Expression of Transmembrane Serine Protease 2 (TMPRSS2),” JAMA 324, no. 15 (2020): 1–2.
12. Stacy Malkan, “FOI Documents on Origins of COVID-19, Gain-of-Function Research and Biolabs,” USRTK.org, July 9, 2021, https://usrtk.org/tag/ecohealth-alliance/.
13. Ibid.
14. Marcus Hoffman, Hannah Kleine-Weber, and Stefan Pöhlmann, “A Multibasic Cleavage Site in the Spike Protein of SARS-CoV-2 Is Essential for Infection of Human Lung Cells,” Molecular Cell 78, no. 4 (May 2020): 779–84.
15. Karl Sirotkin and Dan Sirotkin, “Might SARS-CoV-2 Have Arisen via Serial Passage through an Animal Host or Cell Culture?,” BioEssays 42, no. 10 (October 2020): https://doi.org/10.1002/bies.202000091.
16. Marcus Hoffman, Hannah Kleine-Weber, and Stefan Pöhlmann, “A Multibasic Cleavage Site in the Spike Protein of SARS-CoV-2 Is Essential for Infection of Human Lung Cells,” Molecular Cell 78, no. 4 (May 2020): 779–84; Li-Meng Yan et al., Unusual Features of the SARS-CoV-2 Genome Suggesting Sophisticated Laboratory Modification Rather Than Natural Evolution and Delineation of Its Probable Synthetic Route, New York: Rule of Law Society and Rule of Law Foundation, 2020.
17. Patent Number 7,223,390 B2 issued 29 May 2007 “Insertion of Furin Protease Cleavage Sites in Membrane Proteins and Uses Thereof”
18. S. Hallenberger et al., “Inhibition of Furin-Mediated Cleavage Activation of HIV Glycoprotein gp160,” Nature 360 (1992): 358–361.
19. Ibid.
20. We will leave the discussions of nonstructural protein 7 (NSP7) and the relationship with the Chinese military for another day. See Aartjan J. W. te Velthuis et al., “The SARS Coronavirus nsp7+nsp8 Complex Is a Unique Multimetric RNA Polymerase Capable of Both De Novo Initiation and Primer Extension,” Nucleic Acids Research 40, no. 4 (2012): 1737–47.
21. Wuze Ren et al., “Difference in Receptor Usage between Severe Acute Respiratory Syndrome (SARS) Coronavirus and SARSLike Coronavirus of Bat Origin,” Journal of Virology 82, no. 4 (February 2008): 1899–1907; Yuxuan Hou et al., “Angiotensin-Converting Enzyme 2 (ACE2) Proteins of Different Bat Species Confer Variable Susceptibility to SARS-CoV Entry,” Archives of Virology 155, no. 10 (October 2010): 1563–69, doi:10.1007/s00705-010-0729-6; HA Harrop and CC Rider, “Heparin and its derivatives bind to HIV-1 recombinant envelope glycoproteins, rather than to recombinant HIV-1 receptor, CD4,” Glycobiology 8, no. 2 (1998):131-137; R Mahfoud R et al., “Identification of a common sphingolipid-binding domain in Alzheimer, prion, and HIV-1 proteins,” J Biol Chem 277, no. 13 (2002):11292-11296; Y Lu, DX Liu, JP Tam, “Lipid rafts are involved in SARS-CoV entry into VERO E6 cells,” Biochemical and Biophysical Research Communications (2008): 344-349; Richard M. Fleming, Unmasking COVID—Part 1 (self-pub., 2020), Kindle, https://www.amazon.com/Unmasking-CoViD-Dr-Richard-Fleming-ebook/dp/B08N5... A Bachis A et al., “Human Immunodeficiency Virus Type I Alters Brain-Derived Neurotrophic Factor Processing in Neurons,” J Neurosci 32, no. 28 (2012): 9477-9484. Supported by AIDS Research and Reference Reagent Program (Dr. R. Gallo, Division of AIDS, NIAID, NIH); RM Fleming RM, MR Fleming, and GM Harrington, “Weight Loss vs. Heart Disease: Weight Loss is Determined by Caloric Intake. Heart Disease is Determined by Dietary Inflammatory Components. True Quantification of Coronary Artery Disease Measured by AI Using FMTVDM,” Arch Med 10, no. 5 (2018): 3, DOI:10.21767/1989-5216.1000284; RM Fleming, “The Pathogenesis of Vascular Disease” in the Textbook of Angiology, Chapter 64, Ed. John C. Chang (New York, NY: Springer-Verlag, 1999), 787-798. doi:10.1007/978-1-4612-1190-7_64.
22. Ibid.
23. Ibid.
24. Yuxuan Hou et al., “Angiotensin-Converting Enzyme 2 (ACE2) Proteins of Different Bat Species Confer Variable Susceptibility to SARS-CoV Entry,” Archives of Virology 155, no. 10 (October 2010): 1563–69, doi: 10.1007/ s00705-010-0729-6.
25. Ibid.
26. Dr. Shi Zhengli is also known as Dr. Shi Zhengli-Li, depending upon the published material.
27. Y. Yang et al., “Two Mutations Were Critical for Bat-to-Human Transmission of Middle East Respiratory Syndrome Coronavirus,” Journal of Virology 89, no. 17 (2015): 9119–23.
28. National Science Advisory Board for Biosecurity, U.S. Government Gain-of-Function Deliberative Process and Research Funding Pause on Selected Gain-of-FunctionResearch Involving Influenza, MERS, and SARS Viruses, October 17, 2014, http://www.phe.gov/s3/dualuse/Documents/gain-of-function.pdf.
29. Wuze Ren et al., “Difference in Receptor Usage between Severe Acute Respiratory Syndrome (SARS) Coronavirus and SARSLike Coronavirus of Bat Origin,” Journal of Virology 82, no. 4 (February 2008): 1899–1907.
30. A molecule combined of both a carbohydrate and protein.
31. L. Du et al., “The Spike Protein of SARS-CoV—a Target for Vaccine and Therapeutic Development,” Nature 7 (2009): 226–36.
32. B. J. Bosch et al., “The Coronavirus Spike Protein Is a Class I Virus Fusion Protein: Structural and Functional Characterization of the Fusion Core Complex,” Journal of Virology 77, no. 16 (2003): 8801–11.
33. “Lethal Deception,” Rumble.com, April 22, 2021. Video, 1:31:19, https://rumble.com/vfy3xflethal-deception.html.
34. Prashant Pradhan, “Uncanny Similarity of Unique Inserts in the 2019-nCoV Spike Protein to HIV-1 gp120 and Gag,” BioRXiv (February 2, 2020): https://doi.org/10.1101/2020.01.30.927871.
35. Chengxin Zhang et al., “Protein Structure and Sequence Re-Analysis of 2019-nCoV Genome Does Not Indicate Snakes as Its Intermediate Host or the Unique Similarity between Its Spike Protein Insertions and HIV-1,” BioRXiv (February 8, 2020): https://doi.org/10.1101/2020.02.04.933135.
36. Ibid.
37. “Lethal Deception,” Rumble.com, April 22, 2021. Video, 1:31:19, https://rumble.com/vfy3xflethal-deception.html.
38. “Luc Montagnier,” Wikipedia, last updated July 21, 2021, https://en.wikipedia.org/wiki/Luc_Montagnier.
39. J. C. Perez and L. Montagnier, “COVID-19, SARS, and Bats Coronaviruses Genomes Peculiar Homologous RNA Sequences,” International Journal of Research 8, no. 7 (July 2020): 217–63.
40. J. C. Perez and L. Montagnier, “COVID-19, SARS and Bats Coronaviruses Genomes Unexpected Exogenous RNA Sequences,” https://www.researchgate.net/publication/341756383.
41. Ibid.
42. J. C. Perez and L. Montagnier, “COVID-19, SARS, and Bats Coronaviruses Genomes Peculiar Homologous RNA Sequences,” International Journal of Research 8, no. 7 (July 2020): 217–63.
43. A codon is a three nucleotide sequence. Each codon codes for a specific amino acid. Therefore, each three nucleotide sequence (codon) codes for a specific amino acid.
44. J. C. Perez and L. Montagnier, “COVID-19, SARS, and Bats Coronaviruses Genomes Peculiar Homologous RNA Sequences,” International Journal of Research 8, no. 7 (July 2020): 217–63.
45. Li-Meng Yan et al., “The Wuhan Laboratory Origin of SARSCoV-2 and the Validity of the Yan Reports Are Further Proved by the Failure of Two Uninvited “Peer Reviews,” http://www.researchgate.net/publication/350523980; Li-Meng Yan et al., Unusual Features of the SARS-CoV-2 Genome Suggesting Sophisticated Laboratory Modification Rather Than Natural Evolution and Delineation of Its Probable Synthetic Route, New York: Rule of Law Society and Rule of Law Foundation, 2020, md5:95dd4b8062a82f09779e39f5bbb7a487.
46. “Severe Acute Respiratory Syndrome (SARS)–Corona Virus (CoV) 2, from Infection to COVID-19. Treatments and Vaccines,” FlemingMethod.com, n.d., illustration, https://www.flemingmethod.com/documentation.
47. Electronic Support for Public Health—Vaccine Adverse Event Reporting System (ESP:VAERS). Submitted to AHRQ Grant Final Report. Grant ID: R18 HS 017045.
48. “Death and Mass Injury from the Swine Flu Vaccine of 1976, Back when 60 Minutes Did Their Job,” Bitchute.com, May 17, 2021. Video: 14:31, https://www.bitchute.com/video/0lFlz0WzgU3r/.
49. “Guillain-Barré Syndrome Fact Sheet,” National Institutes of Health, n.d., https://www.ninds.nih.gov/Disorders/Patient-Caregiver-Education/Fact-She....
50. R. M. Fleming, “The Pathogenesis of Vascular Disease,” in Textbook of Angiology, ed. John C. Chang (New York: Springer Verlag, 1999), 787–98, doi:10.1007/978-1-4612-1190-7_64.
51. Ibid.
52. Dominic Wichmann et al., “Autopsy Findings and Venous Thromboembolism in Patients With COVID-19,” Annals of Internal Medicine (August 18, 2020): doi:10.7326/M20-2003.
53. J. Bart Classen, “Review of COVID-19 Vaccines and the Risk of Chronic Adverse Events Including Neurological Degeneration,” J Med - Clin Res & Rev 5, no. 4 (2021): 1-7.; J. Bart Classen, “COVID-19 RNA Based Vaccines and the Risk of Prion Disease,” Microbiol Infect Dis 5, no. 1 (2021): 1-3; Jenny Meinhardt et al., “Olfactory Transmucosal SARS-CoV-2 Invasion as a Port of Central Nervous System Entry in Individuals with COVID-19,” Nature Neuroscience 24 (2021): 168–75, https://doi.org/10.1038/s41593-020-00758-5; Elizabeth M. Rhea et al., “The S1 Protein of SARS CoV-2 Crosses the Blood-Brain Barrier in Mice,” Nature Neuroscience 24 (2021): 368–78, https://doi.org/10.1038/s41593-020-00771-8; Mariano Carossino et al., “Fatal Neuroinvasion of SARS-CoV-2 in K18-hACE2 Mice Is Partially Dependent on hACE2 Expression,” BioRXiv (January 15, 2021): https://doi.org/10.1101/2021.01.13.425144; Ingrid H. C. H. M. Philippens et al., “SARS-CoV-2 Causes Brain Inflammation and Induces Lewy Body Formation in Macaques,” BioRXiv (May 5, 2021): https://doi.org/10.1101/2021.02.23.432474.
54. K. Bahl et al., “Preclinical and Clinical Demonstration of Immunogenicity by mRNA Vaccines against H10N8 and H7N9 Influenza Viruses,” Molecular Therapy 25, no. 6 (2017): 1316–27.
55. Mariano Carossino et al., “Fatal Neuroinvasion of SARS-CoV-2 in K18-hACE2 Mice Is Partially Dependent on hACE2 Expression,” BioRXiv (January 15, 2021): https://doi.org/10.1101/2021.01.13.425144.
56. Ingrid H. C. H. M. Philippens et al., “SARS-CoV-2 Causes Brain Inflammation and Induces Lewy Body Formation in Macaques,” BioRXiv (May 5, 2021): https://doi.org/10.1101/2021.02.23.432474.
57. L. Jiao et al., “The Olfactory Route Is a Potential Way for SARSCoV-2 to Invade the Central Nervous System of Rhesus Monkeys,” Signal Transformation and Targeted Therapy 6 (2021): 169, https://doi.org/10.1038/s41392-021-00591-7.
58. Ingrid H. C. H. M. Philippens et al., “SARS-CoV-2 Causes Brain Inflammation and Induces Lewy Body Formation in Macaques,” BioRXiv (May 5, 2021): https://doi.org/10.1101/2021.02.23.432474.
59. R. M. Fleming et al., “The Importance of Differentiating between Qualitative, Semi-Qualitative and Quantitative Imaging–Close Only Counts in Horseshoes,” invited editorial, European Journal of Nuclear Medicine and Molecular Imaging 47, no. 4 (2020): 753–55, doi:10.1007/s00259-019-04668-y, published online January 17, 2020, https://link.springer.com/article/10.1007/s00259-019-04668-y.
60. “Lewy Body,” Wikipedia, last updated July 21, 2021, https://en.wikipedia.org/wiki/Lewy_body.
61. Rossana Segreto et al., “An Open Debate on SARS-CoV-2’s Proximal Origin Is Long Overdue,” https://www.researchgate.net/publication/349125078.
62. J. B. Classen, “Review of COVID-19 Vaccines and the Risk of Chronic Adverse Events Including Neurological Degeneration,” Journal of Medical-Clinical Research & Reviews 5, no. 4 (2021): 1–7.
63. S. Seneff and G. Nigh, “Worse Than the Disease? Reviewing Some Possible Unintended Consequences of the mRNA Vaccines against COVID-19,” International Journal of Vaccine Theory, Practice, and Research 2, no. 1 (2021): 402–43.
64. A biological is a diagnostic, pregentive, or therapeutic deived or obtained from living organisms and their product, including serum, vaccine, antigen, and antitoxin.
65. “Severe Acute Respiratory Syndrome (SARS)–Corona Virus (CoV) 2, from Infection to COVID-19. Treatments and Vaccines,” FlemingMethod.com, n.d., illustration, https://www.flemingmethod.com/documentation.
66. Karen O’Hanlon Cohrt, “How to Calculate the Number of Molecules in Any Piece of DNA,” Bitesize Bio, https://bitesizebio.com/20669/how-to-calculate-the-number-of-molecules-i... “Reverse Engineering the Source Code of the BioNTech/Pfizer SARS-CoV-2 Vaccine,” December 25, 2020, https://berthub.eu/articles/posts/reverse-engineering-source-code-of-the....
